一.响应国家推进核酸检测能力建设新要求: 优化创新,高效检测
在2020年8月27日,国务院联防联控机制印发《进一步推进新冠病毒核酸检测能力建设工作方案》,提出了推进核酸检测能力建设的新要求,也提出了新冠核酸快速检测的要求。明德生物积极响应《方案》要求,创新推出新冠核酸快速检测解决方案,旨在加强检测技术方法优化创新,进一步提高检测效率和质量。该方案既适用于大中小医院的发热门诊、PCR实验室等,也适用于第三方检验所、疾控中心、海关机场检疫等,还适配现场快速检测车、移动方舱,可实现突发事件的现场快速检测。


二.明德生物新冠核酸快速检测解决方案:至快至准,随到随检!
明德生物新冠核酸快速检测解决方案可同步完成采样、病毒灭活与核酸释放,配合快速核酸检测系统,可减少设备投入、大幅度降低检测成本,节约人力和时间,适合小样本量的快速及时测定。此方案从技术上优化创新,至快至准,随到随检!
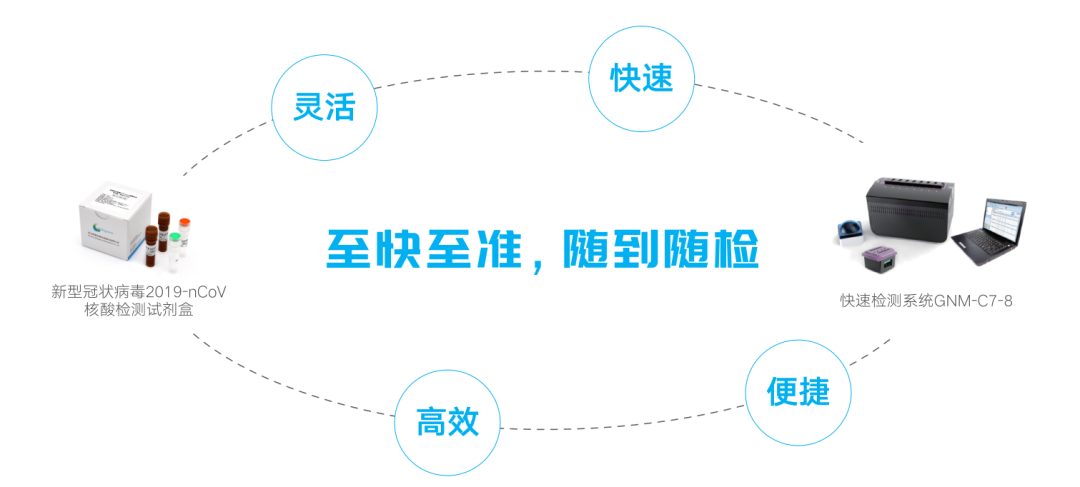
灵活:八个模块独立工作,样本随到随检,多种项目同时检测;
快速:从采样完成到获得结果可在60分钟内完成;
高效:采样、病毒灭活和核酸获取同步完成;
便捷:预混试剂,减少操作。
新技术、去流程、更高效!
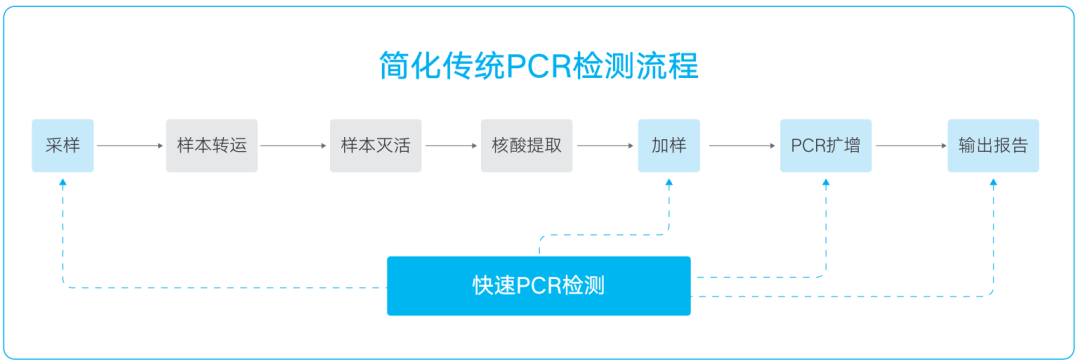
明德生物新冠核酸快速检测解决方案从采样完成到得出检测结果,可在60分钟内完成1-8人份新冠核酸检测,相比传统的磁珠法核酸提取(45分钟)结合核酸扩增检测(110分钟),整体可减少大约60%的时间。
具体步骤如下:
采集到的样本直接放入带有600μl样本释放剂(具有病毒灭活功能)的一次性病毒采样套装中,进行核酸释放;
分别吸取5μl 裂解样本和20μl 2019-nCoV反应液至反应杯中,完成反应体系配置;
利用快速PCR仪高效扩增,读取结果。
三.明德生物新冠核酸快速检测解决方案
十问十答,全面解析
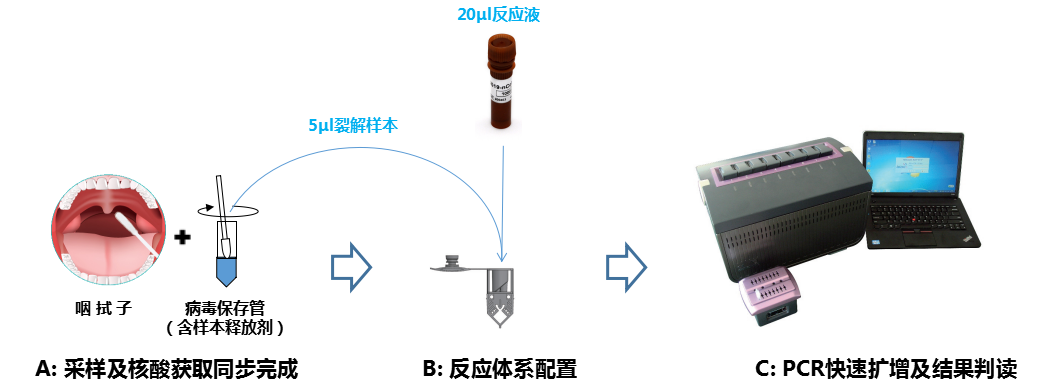
1. 明德的新冠核酸快速检测解决方案:
采集到的样本直接放入带有样本释放剂的一次性病毒采样套装中;吸取裂解样本加入到带有核酸扩增试剂的反应杯中,上机操作并读取结果。
2. 检测原理:
荧光定量PCR检测原理相较于恒温扩增具有技术成熟、特异性、灵敏度高、适合多重检测、试剂成本低等特点。
3. 检测通量和独立运行:
明德提供的C7型快速PCR系统,具备8个独立检测位,每个检测位可使用完全不同的反应程序,完全不同的检测样本,完全不同的检测项目,并能同时上样检测,或者分开独立上样检测!真正做到随到随检,特别适合发热门诊,移动方舱PCR实验室等场景的使用。
4. 是否需要核酸提取:
明德的新冠核酸快速检测解决方案,在样本采集阶段,核酸释放同步完成,且释放后的核酸在室温下可稳定保存48小时。使用原始样本上机操作,无单独的核酸提取步骤,不占用检测时间。
5. 是否为开放平台可使用其它品牌试剂:
明德的新冠核酸快速检测解决方案中配套C7快速PCR,试剂开放,可使用其它品牌的核酸检测试剂开展新的项目,如,甲乙流病毒核酸检测、肠道病毒核酸检测等。不会因匹配不到其它检测项目的试剂造成设备的闲置。
6. 荧光通道数:
C7具备高灵敏的4荧光检测通道,检测项目的可扩展性要强于2荧光通道的设备。
7. 样本进结果出:
明德的方案采用原始样本加入反应管,上机后直接读取结果,属于“样本进、结果出”,符合分子诊断POCT的设计理念,使用更加便捷。
8. 完整时间和检测时间:
完整时间为采样完成到出结果的时间,检测时间为上机核酸扩增的时间。差异主要在于上机前的操作时间,两者的时间差越少,证明人工操作的时间越少。
9. 最低检测限:
明德的新冠核酸检测试剂盒说明书LOD值解释为500copies/ml,中检院检测可达S6级别,即实际LOD值为137copies/ml以下,性能优异,能进一步降低核酸阳性漏检风险。
10. 配套新冠核酸检测试剂是否大面积进入集采目录:
目前明德的新冠核酸检测试剂盒已在全国20多个省市进入集中采购目录,可在要求集采的省份中大规模销售。


