
2019 年 12 月,新型冠状病毒 ( severe acute re- spiratory syndrome coronavirus 2,SARS-CoV-2) 感染引起的新 型 冠 状 病 毒 肺 炎 ( coronavirus disease 2019, COVID-19) 疫情暴发,并在全球范围内大流行。
虽然我国对 COVID-19 疫情的防控取得了阶段性胜利,但全球疫情仍极为严峻。当前我国疫情防控的重点,已从对本土病例的防控转变为对境外输入性病例的防控,以及对经冷链运输进口物品携带污染及密切接触人群的监测。
各临床医疗机构和疾病预防控制部门的SARS-CoV-2 检测工作已呈常态化,应大力提升并具备 随时应对新一波疫情暴发、流行的能力。基于目前临床检测 SARS-CoV-2 所积累的经验和常见问题,并结合 最新研究进展,中国医院协会临床微生物实验室专业委员会组织我国临床微生物学、分子生物学和免疫学 检验相关领域专家共同撰写了 《新型冠状病毒实验室 检测专家共识》。
本共识明确了目前 SARS-CoV-2 临床常用检测方法的技术特点、注意事项、生物安全要求、 检测和结果解读的常见问题及应对策略,以期在疫情防控常态化形势下,为临床实验室正确、高效开展 SARS-CoV-2 检测提供参考意见。
01.共识形成方法
本共识由中国医院协会临床微生物实验室专业委员会发起,共识专家组由该委员会委员及其推荐的相 关领域专家共同组成,并通过共识形成会议法[1]达成共识意见。专家组拟订关键问题和共识提纲后,以“新型冠状病毒”“新型冠状病毒肺炎”“severe acute respiratory syndrome coronavirus 2”“SARS-CoV-2”“coro- navirus disease 2019”和 “COVID-19”为关键词,检索 2019 年 12 月至 2020 年 11 月期间 PubMed、EMBase、 Cochrane Library、中国知网、万方数据、维普网数据 库中关于 SARS-CoV-2 和 COVID-19 实验室检测相关的中、英文文献,以及国家卫生健康委员会和世界卫生组织发布的 COVID-19 诊疗方案和技术标准,国内 外学术组织现行的感染控制、生物安全相关标准、指 南和共识等。经 3 轮远程会议讨论及反复修订,形成共识草案,然后由所有专家对草案进行函审并提出书面意见,共收集函审意见 539 条 ( 含重复意见) ,全 部意见在第 4 次会议上逐条进行讨论确认,并采纳其中的 458 条,经 23 次修订最终形成本共识终稿。鉴 于目前对 SARS-CoV-2 的认知程度及共识参与人员的 专业背景,本共识的制定可能存在一定局限性。
02.新型冠状病毒核酸检测
2. 1 核酸检测方法
国家卫生健康委员会发布的 《新型冠状病毒肺炎诊疗方案 ( 试行第八版) 》[2]指出,对疑似病例采用实时荧光 PCR 法检测 SARS-CoV-2 核酸为阳性或病毒基因测序结果与已知的 SARS-CoV-2 序列高度同源,即 可确诊为 SARS-CoV-2 感染。核酸检测阳性是发现 SARS-CoV-2 携带者 ( SARS-CoV-2 核酸阳性但无明显临床和影像学表现,且血清特异性 SARS-CoV-2 抗体阴 性者) 和确诊 SARS-CoV-2 感染的金标准。在 SARS-CoV-2 基因组序列确定的情况下[3-5], 靶标可针对病毒基因组保守区域进行设计。
SARS- CoV-2 核酸检测的靶基因主要包括: 开放读码框 1ab ( open reading frame 1ab,ORF1ab) 、核壳蛋白 ( nu- cleocapsid protein,N) 、包 膜 蛋 白 ( envelop protein, E) 和刺突糖蛋白编码 ( spike glycoprotein,S) 基 因[6]。目前在中国获批的试剂盒主要是针对其中的 一个或多个靶标进行检测,建议同时检测 2 个及以上 靶标,以保证结果的特异度和准确性。
目前国家药品监督管理局 ( National Medical Pro- ducts Administration,NMPA) 批准上市的 SARS-CoV-2 核酸检测试剂盒所采用的检测方法主要有实时荧光PCR 法、恒温扩增法、联合探针锚定聚合测序法、 杂交捕获免疫荧光法、RNA 捕获探针法、RNA 恒 温扩增捕获—金探针层析法、双扩增法以及基于下 一代 测 序 技 术 ( next-genera-tion sequencing,NGS ) 的 SARS-CoV-2 核酸检测方法等。
2. 1. 1 实时荧光 PCR 法
目前医疗机构临床实验室开展 SARS-CoV-2 核酸 检测所采用的方法以实时荧光 PCR 法为主,其检测下 限为 102 ~103 copies/mL,部分产品可达 10copies/mL。该方法检测耗时存在差异,通常两步法 ( 即核酸提取 与 PCR 扩增步骤独立进行) 约需 3~ 3. 5 h ( 包括核酸 提取 0. 5~1. 5 h,PCR 扩增 1. 5~ 2 h) ,一步法 ( 即核 酸提取与 PCR 扩增一体化) 可缩短至 1 h 以内。
2. 1. 2 恒温扩增法
恒温扩增法是在固定的温度条件下进行扩增, 包含恒温扩增实时荧光法和恒温扩增芯片法。恒温 扩增实时荧光法是将恒温扩增技术和实时荧光检测 技术相结合,可将 SARS-CoV-2 核酸检测全流程时 间缩短至 1. 5 h 以内。恒温扩增芯片法是将恒温扩 增技术与微流控芯片技术相结合,其特点是可在同一份样本中同时检测多种病原体。恒温扩增法具有 集成能力强、自动化程度高、检测时间短、检测下 限低 ( 可达 102 copies/mL) 等特点。
2. 1. 3 其他 PCR 方法
联合探针锚定聚合测序法、杂交捕获免疫荧光法、RNA 捕获探针法、RNA 恒温扩增捕获—金探针层析法、双扩增法和巢式多重 PCR 法在 SARS-CoV-2 核酸检测中亦发挥了重要作用。
在扩增多重病原靶标时,需同时检测 1~ 2 种室内质控,以确保样本处理、 核酸提取及 PCR 反应的有效性。此外,也有研究使 用 PCR-核酸飞行时间质谱进行 SARS-CoV-2 核酸检 测[7]; 或应用质谱技术直接使用临床样本从多组学 角度检测 SARS-CoV-2[8-10]。
SARS-CoV-2 核酸检测的方法较多且各具特点, 即使同一种检测方法,由于检测试剂生产厂家或检 测仪器不同,所需检测时间及检测下限均可能存在差异。因此,在实际工作中实验室应根据所使用的检测试剂及设备说明书,制定相应的标准操作规 程,开展 SARS-CoV-2 核酸检测工作。
2. 1. 4 基于 NGS 的 SARS-CoV-2 核酸检测
NGS 不依赖传统的微生物培养,具有高通量、一次可检测多个靶基因的特点,可发现新发病原 体、监测病原体变异,为诊断试剂、疫苗、药物等 研发和应用提供依据。在此次疫情初期,利用 NGS 从临床样本中成功鉴定出了 SARS-CoV-2 的基因组 序列[11],为 SARS-CoV-2 的早期发现和诊断提供了 重要依据。疫情期间,NMPA 应急批准 SARS-CoV-2 测序试剂盒可用于临床样本的常规检测。但目前NGS 主要用于科研,其临床大规模应用需进一步标准化和规范化。
2. 2 核酸检测注意事项与生物安全要求
SARS-CoV-2 核酸检测主要包括样本采集、转运 和接收、核酸提取、PCR 扩增、报告解读及医疗垃 圾处理等步骤。其注意事项及生物安全要求见表 1。
2. 3 核酸检测结果解读存在的问题与对策
2. 3. 1 核酸检测与复检以下情况建议复检:
( 1) 样本经 PCR 扩增后,目的基因 Ct 值大于试剂说明书阈值,但原始峰图有信号;
( 2) 扩增结果为阳性,但原始峰图并非典型 的 “S”形曲线;
( 3) 双靶标试剂检测结果不一 致;
( 4) 双份试剂检测结果不一致;
( 5) 检测结 果与临床症状、影像学表现不一致;
( 6) 若不同病 程阶段核酸检测结果发生变化,需连续多次采样;
( 7) 大规模人群筛查流行率极低 ( <0. 1%) 时,出 现阳性结果,应使用 1 ~ 2 种更灵敏且扩增区域不同 的试剂复检[12]。
2. 3. 2 流行病学结合临床分析原则
虽然核酸检测是 SARS-CoV-2 病原学诊断的金标准,但仍存在一定的局限性。当临床高度怀疑 SARS- CoV-2 感染而核酸检测阴性时,需结合患者肺部 CT、 SARS-CoV-2 特异性抗体、血常规等其他检测结果进 行综合判断。
2. 4 核酸检测结果假阴性、假阳性分析
2. 4. 1 假阴性结果主要原因:
( 1) 感染的不同时期,病毒在人体不同部位载量存在差异;
( 2) 样本 采集不规范;
( 3) 样本转运、保存或灭活方法不当, 导致 RNA 降解;
( 4) 病毒基因序列发生变异。
2. 4. 2 假阳性结果多由实验室污染或操作不当造成。
2. 4. 3 避免假阴性或假阳性结果的应对策略
( 1) 试剂质量控制: 对不同的 SARS-CoV-2 核酸 检测试剂性能进行比较,对试剂的性能参数进行验 证,选取各种性能均较好的试剂。
( 2) 操作质量控制: 核酸检测的整个流程操作 复杂,不同产品的反应体系及适用机型等存在差异, 实验人员应严格按照各自产品说明书要求进行操作。实验室应对样本采集、转运与保存、核酸提取、PCR 扩增、结果审核及报告进行全流程质量控制。
( 3) 设置对照: 除每个检测批次至少设置 3 份 阴性对照、1 份弱阳性对照 ( 第三方质控品) [12]和内 标控制孔外,应设置空白对照以监测实验室污染。
( 4) 多指标诊断: 对核酸检测结果为阴性但临 床疑似感染患者,应进行多部位样本、多次采样检 测,并结合血清学结果、影 像 学 表 现 等 进 行 综 合判断。

03新型冠状病毒免疫学检测
N 蛋白和 S 蛋白是免疫检测的主要抗原靶点。N蛋白位于病毒颗粒包膜内核,与正义单链 RNA 缠绕并将其封装成 RNA 核衣壳体; S 蛋白分布于病毒外壳,冷冻电镜超微结构为三聚体,其受体结合结构域receptor binding domain,RBD) 与人体细胞血管紧张 素转换酶 2 受体结合后入侵人体细胞并导致感染[25]。
3. 1 新型冠状病毒特异性抗体检测
《新 型 冠 状 病 毒 肺 炎 诊 疗 方 案 ( 试 行 第 七 版) 》[26]首次将 “血清 SARS-CoV-2 特异性抗体 IgM 和 IgG 阳性; 血清 SARS-CoV-2 特异性抗体 IgG 由阴 性转为阳性或恢复期较急性期 4 倍及以上升高”作为疑似病例的确诊标准之一。
《新型冠状病毒肺炎诊疗方案 ( 试行第八版) 》[2]将 “SARS-CoV-2 特异性抗 体 IgM 阳性”作为疑似病例诊断依据之一,并指出 “SARS-CoV-2 特异性抗体 IgM 和 IgG 在发病 1 周内阳 性率较低,一般不单独以血清学检测作为诊断依据, 需结合流行病学史、临床表现和基础疾病等情况进行综合判断”,强调动态观察抗体水平变化。
因此,核酸检测仍是判断 SARS-CoV-2 感染的金标准[27],抗体 检测可用于核酸检测阴性疑似病例的补充检测,或在疑似病例诊断中与核酸检测联合应用,但不能代替核 酸检测单独作为 SARS-CoV-2 感染者确诊与否的依 据,亦不适用于一般人群的筛查。随着 SARS-CoV-2 疫苗接种人群的逐渐扩大,详细询问患者疫苗接种史 及免疫相关基础疾病,对理解其抗体水平变化趋势及 抗体检测结果至关重要。
3. 1. 1 抗体检测方法
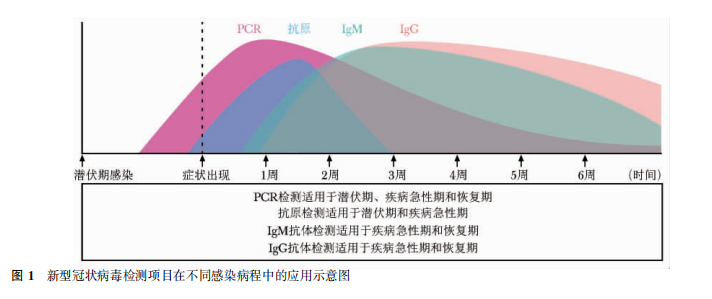
SARS-CoV-2 抗体检测试剂多以 N 蛋白和 S 蛋白作为捕获抗原,主要检测 IgM、IgG。一般情况下,机体感染病毒后抗体水平变化如图 1。
IgM 产生最早 ( SARS-CoV-2 特异性抗体 IgM 多在发病 3~ 5 d 后开始 出现阳性[2,28]) ,但浓度及亲和力较低、维持时间 短,是急性期感染的诊断指标; IgG 产生较晚 ( 一般 在出现症状一周后[28-29]) ,但浓度及亲和力高、维持 时间较长 ( 有研究显示 SARS-CoV-2 特异性抗体 IgG 维持时间约为 3~ 6 个月) ,是感染中后期或既往感染的诊断指标[30]。
机体感染 SARS-CoV-2 产生抗体的时 间和规律仍需更多的科学研究加以证实。NMPA 已批准的 SARS-CoV-2 抗体检测方法主要有 化学发光法、胶体金法和荧光免疫层析法。化学发光 法具有线性范围宽、通量高、自动化程度高、操作易 于标准化等特点,但依赖于特定的化学发光检测仪, 成本较高,临床普及受限。
胶体金法和荧光免疫层析 法操作简便、快捷,突破了现有检测技术对人员、场 所的限制,可在 15 min 内获得结果,适用于基层医疗 单位及现场筛查,但灵敏度受限[31]。上述方法均为定 性检测,目前尚无可用于定量分析的试剂盒。
3. 1. 2 抗体检测注意事项与生物安全要求
SARS-CoV-2 抗体检测的注意事项及生物安全要求见表 2。

3. 1. 3 抗体检测结果解读中的问题与对策
3. 1. 3. 1 抗体检测与复检
( 1) 在低流行风险人群中,若抗体检测结果呈 弱阳性或阳性,建议结合核酸检测等结果进行解读, 亦可采用另一种高特异度的方法或试剂盒进行复检;
( 2) 如抗体检测结果呈阴性,但临床怀疑为 SARS-CoV-2 感染,建议进行核酸检测,并采用另一 种高灵敏度的方法或试剂盒进行复检;
( 3) 如考虑存在干扰因素,可通过样本灭活、 使用类风湿因子吸附剂处理等方式处理后,进行 复检。
3. 1. 3. 2 不同检测方法间性能存在差异的原因
( 1) 原理不同: 双抗原夹心法、捕获法、间接法等不同检测方法的灵敏度不同。
( 2) 捕获抗原不同: ①抗原种类或选择的片段 不同: N 蛋白的免疫原性和特异度均高于 S 蛋白,但灵敏度低[37],不同试剂盒可能单独采用 S 蛋白、N蛋白或 S+N 蛋白抗原组合、全长或仅 RBD 为捕获抗 原; ②S ∶ N 抗原比不同; ③体外重组蛋白表达系统不同,真核表达系统表达的蛋白具有一定程度的折叠加工和糖基化修饰,性质较原核表达系统表达的蛋白更稳定,特异度更高。
( 3) 待检抗体种类不同: 如单独检测 ( IgM 或 IgG) 、双重检测 ( IgM +IgG) 或总抗体检测 ( IgM + IgG+IgA) ,联合检测可提高检出率。
3. 1. 3. 3 抗体检测结果假阴性、假阳性分析
假阴性检测结果的可能原因:
( 1) 抗体表达存 在窗口期;
( 2) 检测试剂盒灵敏度受限;
( 3) 样本 保存或实验操作不当;
( 4) 轻症患者抗体反应较 弱[38];
( 5) 样本灭活导致低水平抗体降解。
假阳性检测结果的可能原因:
( 1) 不同种属冠状病毒的 N 蛋白或 S 蛋白存在免疫交叉反应[39];
( 2) 患 者自身存在高浓度类风湿因子、抗核抗体等免疫学干 扰因素[40-41];
( 3) 实验室或试剂盒污染;
( 4) 样本 检测前的灭活可能导致荧光免疫层析法检测假阳 性[42];
( 5) 阳性判断值的设定: 阳性判断值附近的 弱阳性,有一部分可能为假阳性,因此弱阳性患者建议 3~ 5 d 后复查;
( 6) 样本溶血、血液样本凝固不 全或患者出现黄疸等,可能会导致假阳性结果,但目前缺乏实验证据,需进一步研究验证。
3. 2 新型冠状病毒核酸和特异性抗体联合检测结果解读
核酸检测结果是判断患者有无 SARS-CoV-2 感染的 直 接 证 据,抗 体 检 测 结 果 可 作 为 辅 助 判 断 SARS-CoV-2 感染的间接证据以及评估疫苗效果, 核酸检 测 与 抗 体 检 测 各 有 优 劣,不 能 互 相 替 代。
单独采用抗体检测时,其结果解读需谨慎,尤其 应核对患者流行病学史、是否接种 SARS-CoV-2 疫 苗及 是 否 合 并 免 疫 相 关 基 础 疾 病。人 体 感 染SARS-CoV-2 后核酸载量、抗体水平呈现不同的变 化 ( 图 1) ,在不同病程阶段,核酸和抗体检测的 灵敏度不同,特别是在感染中后期,核酸检出率降低,抗体检出率升高,核酸与抗体联合检测可降低漏诊率,提高检出率,对临床诊断具有重要 意义。
针对实验室 SARS-CoV-2 核酸及抗体联合检 测结果的解读见表 3。

3. 3 新型冠状病毒抗原检测
抗原检测是指应用 SARS-CoV-2 特异性抗体直接 检测样本中的病原体,其结果可作为早期确认该病原 体感染与否的直接证据,且具有操作简便、报告时间 短等优势。所检测抗原主要是 N 蛋白和 S 蛋白,N 蛋 白在 β 属冠状病毒之间相对保守、合成数量多,具 有很强的抗原性,其抗原决定簇是特异性抗体结合的主要位点。
抗原检测适用的样本类型一般为感染部位 样本,主要为鼻咽拭子和肺泡灌洗液等。检测结果受 样本质量、感染部位及病毒表达量等因素影响较大, 灵敏度低、易产生假阴性结果。如何提高抗原检测的 灵敏度是影响该检测方法在临床上应用的关键问题, 需进一步筛选制备高亲和力和高特异度的抗体,以用 于抗原检测试剂的开发。
目前,国内外许多企业致力于 SARS-CoV-2 抗原 检测试剂盒的研发,已有试剂盒获得食品药品监督管 理局紧急使用授权并批准上市,NMPA 亦应急审批通 过 2 款 SARS-CoV-2 抗原检测试剂盒上市。
04.新型冠状病毒培养
细胞培养分离病毒是病原学鉴定的金标准,所获 毒株是检测试剂和疫苗开发、抗病毒药物筛选等研究的重要基础。SARS-CoV-2 的培养必须在具备生物安 全三级 ( BSL-3) 及以上资质的实验室内进行,不得 在临床常规生物安全二级 ( BSL-2) 实验室中进行, 因此不推荐新型冠状病毒培养作为常规诊断方法。
鼻咽拭子、痰及其他下呼吸道分泌物等临床样本均可通过接种人呼吸道上皮细胞、Vero-E6 和 Huh-7 细胞系等进行分离培养。选取经荧光定量 PCR 和/或 NGS 方 法检测出核酸阳性且 Ct 值较低 ( 即病毒载量较高) 的样本进行分离培养,应考虑取材部位、取材时间及 样本送检与保存等因素的影响。
05.总结
SARS-CoV-2 是一种新发病原体,目前对该病毒的致病性、检测方法性能的了解仍有限,需开展更多的基础和临床研究,以提高其检测方法效能、提升临 床及实验室诊断能力。本共识基于现有研究结果和相关指南,对 SARS-CoV-2 实验室检测相关问题进行了 分析,并提出了应对策略,以供临床实验室参考和应 用。
在 SARS-CoV-2 检测过程中,临床实验室应积极与临床沟通,结合患者流行病学史、临床表现、影像 学改变及其他检测结果综合分析。对于未来可能发生甚至目前已经发生的病毒生物学变异所带来的检测挑 战,仍有诸多未知因素有待进一步探索和研究。
参考资料:中国医院协会临床微生物实验室专业委员会,《新型冠状病毒实验室检测专家共识》


